摘要:元素周期表前20个元素是化学学科的基础,涵盖了从氢到钙的各类元素。这些元素在自然界中广泛存在,具有独特的原子结构、物理和化学性质。这些元素的奥秘在于其性质随着原子序数的变化而呈现周期性变化,反映了电子排布和量子效应的规律。这些元素在材料科学、电子工业等领域有广泛应用,是科学研究和技术发展的重要基石。
本文目录导读:
元素周期表是化学学科的核心组成部分,它揭示了元素的性质与原子结构之间的关系,在这篇文章中,我们将深入探讨周期表前20个元素,这些元素在化学领域中具有极其重要的地位,我们将从它们的发现历史、基本性质、应用领域等方面展开讨论。
发现历史
自18世纪科学家们开始系统地研究化学元素以来,元素的发现经历了漫长而曲折的过程,周期表中的前20个元素,大多数在19世纪末之前就已经被发现,氢、氦、锂、铍等元素的发现都与早期化学家的辛勤努力密不可分,随着科技的发展,科学家们逐渐揭示了这些元素的性质与结构之间的关系,为元素周期表的建立奠定了基础。
前20个元素的基本性质
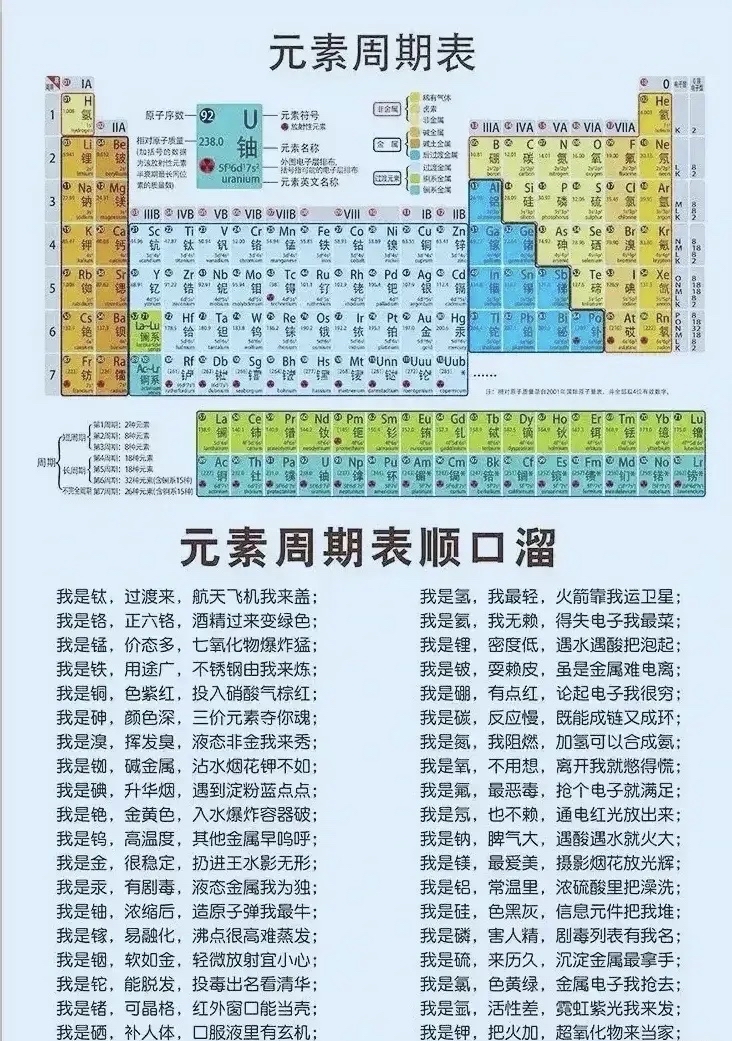
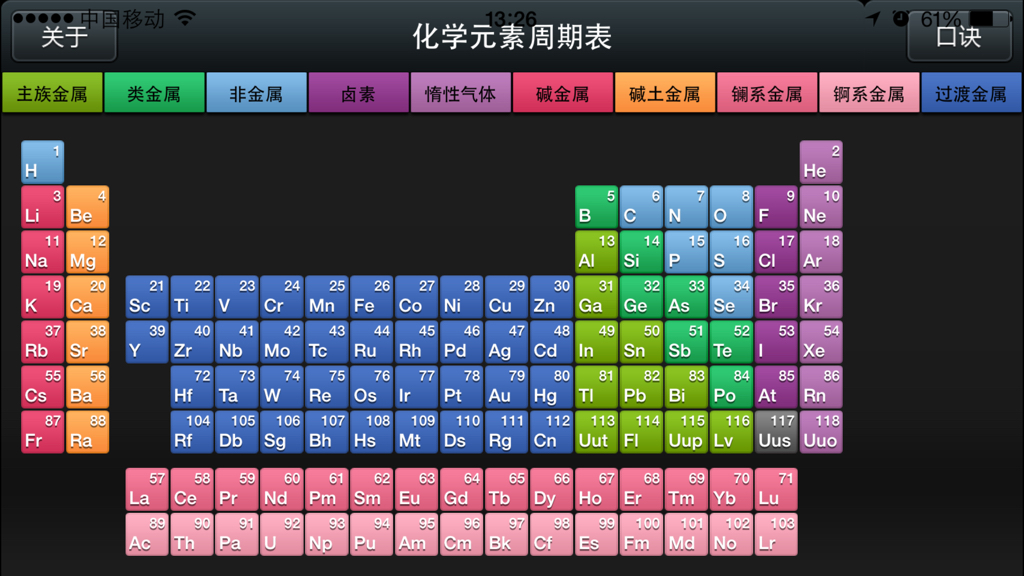
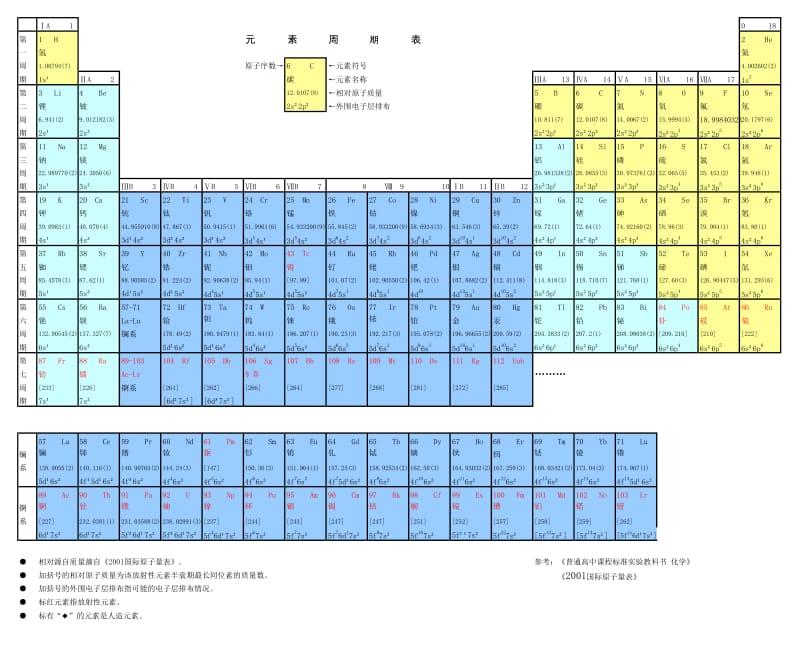
周期表前20个元素包括氢(H)、氦(He)、锂(Li)、铍(Be)、硼(B)、碳(C)、氮(N)、氧(O)、氟(F)、钠(Na)、镁(Mg)、铝(Al)、硅(Si)、磷(P)、硫(S)、氯(Cl)、钾(K)、钙(Ca)、铁(Fe)等,这些元素在自然界中广泛分布,具有不同的物理和化学性质,氢是最轻的元素,而铁则是地球上最常见的金属元素,这些元素的原子序数、原子质量、电负性、电子排布等性质各异,为化学研究提供了丰富的素材。
三.应用领域
这些元素在各个领域有着广泛的应用,氢作为一种清洁能源,在能源领域具有巨大的潜力,氦在制造超导磁体和高空飞行中发挥着关键作用,锂电池广泛应用于电子设备领域,为移动设备提供了源源不断的动力,铝作为一种轻质金属,广泛应用于航空、建筑等领域,铁则是制造钢铁的重要原料,为人类社会的繁荣发展做出了巨大贡献。
周期表前20个元素还在材料科学、生命科学、医学等领域发挥着重要作用,碳是生命的基础,构成了一切生物体内的有机物质,氮是合成肥料的重要元素,对农业生产具有重要意义,硅在电子工业中发挥着关键作用,是现代信息技术的基石,磷和硫在生命过程中也扮演着重要角色,如DNA的合成、蛋白质的合成等。
元素周期表的意义
周期表前20个元素的排列规律揭示了元素性质与原子结构之间的关系,随着原子序数的增加,元素的性质呈现出周期性变化,这一规律为化学研究提供了有力的工具,通过对周期表的研究,我们可以预测未知元素的性质,为新材料的设计和开发提供指导,周期表还为化学反应的研究提供了方便,帮助我们理解化学反应的机理和过程。
周期表前20个元素是化学学科的基础,它们在人类社会的各个领域发挥着重要作用,通过对这些元素的研究,我们不仅可以了解元素的性质与结构之间的关系,还可以为新材料的设计和开发提供指导,推动科技进步和社会发展,随着科技的进步和研究的深入,这些元素的应用领域还将进一步拓展,为人类带来更多的福祉。

 京公网安备11000000000001号
京公网安备11000000000001号 京ICP备11000001号
京ICP备11000001号